Introduzione
L’infertilità maschile può essere, da un punto di vista pratico, classificata in secretoria ed escretoria.
Le forme secretorie (non ostruttive) sono espressione di testicolopatia primaria. La diagnostica ecografica può essere di ausilio nella stima corretta del volume testicolare e nella identificazione di patologie della regione scrotale. Queste ultime comprendono un’ostruzione che può interessare qualsiasi livello del tratto genitale (da prossimale a distale), dall’epididimo all’uretra. La diagnostica ecografica può essere d’aiuto nell’identificare la causa e la sede dell’ostruzione.
L’ecografia scrotale rappresenta la prima linea nella diagnostica dell’infertilità maschile. L’eco-color Doppler (ECD) permette di valutare la vascolarizzazione del testicolo e dell’epididimo. Inoltre, l’ECD del
plesso venoso pampiniforme permette di confermare la diagnosi clinica o di porre diagnosi di un varicocelenon ev idenziabile clinicamente [1,2]. L’ecografia prostato-vescicolare per via trans-rettale (TRUS) permette di ottenere immagini ad alta risoluzione del tratto genitale distale, inclusi i dotti deferenti distali, le vescichette seminali, la prostata e i dotti eiaculatori, ed è considerata essenziale nella diagnosi delle ostruzioni distali del tratto genitale maschile. Va riservata, in prima istanza, ai pazienti con quadro di oligoposia (volume dell’eiaculato <1,5 mL).
L’ecografia nelle forme non-ostruttive
La diagnostica ecografica può essere di ausilio rivelando la possibile riduzione del volume testicolare (<12 ml), le alterazioni dell’ecotessitura e/o della vascolarizzazione parenchimale, la possibile assenza del/dei testicolo/i in sede scrotale, la presenza di varicocele, ecc.
Il plesso pampiniforme, in condizioni normali, consiste in un insieme di vasi di diametro <2 mm che confluiscono nella vena spermatica. La presenza di strutture tubulari anecogene di diametro >2-3 mm superiormente o lateralmente al testicolo e in alcuni casi estese posteriormente e inferiormente, con presenza di reflusso venoso documentabile tramite ECD, permette di porre diagnosi di varicocele [3]. Lo studio ecografico della regione scrotale può contribuire anche a porre il sospetto della presenza di “nutcracker”, condizione caratterizzata da compressione della vena renale tra aorta e arteria mesenterica superiore. In questo caso, il calibro medio delle varici scrotali in clinostatismo appare marcatamente aumentato (>4 mm), l’ECD permette di valutare il picco di velocità di flusso in sede ilare e aortomesenterica [4]. Recentemente è stata descritta l’associazione tra dilatazione del plesso venoso
pampiniforme e plesso venoso periprostatico (evidenziabile mediante TRUS) nei pazienti con varicocele
condizionante la risposta seminologica dopo procedura di correzione del varicocele [5].
L’assenza stabile all’ecografia scrotale di uno o entrambi i didimi depone per anorchia congenita e/o criptorchidismo, i testicoli possono essere documentati nel canale inguinale e in addome come strutture ovoidali ipoecogene, solitamente di dimensioni inferiori alla norma, spesso con microcalcificazioni. La presenza di ipo-atrofia testicolare all’ecografia scrotale indirizza la diagnosi verso una forma non ostruttiva di infertilità, condizione associata a compromissione dei parametri convenzionali e biofunzionali del liquido seminale [6]. In questi casi, l’epididimo può essere regolare. In caso di orchite acuta, l’ecografia mostrerà un volume testicolare ed epididimario aumentati, disomogeneità ecostrutturale ed aumento della vascolarizzazione all’ECD, mentre nelle forme croniche il volume testicolare così come la vascolarizzazione tendono ad essere ridotti con ecostruttura disomogenea e presenza micro- o macrocalcificazioni.
Infine, lo studio ecografico della regione scrotale è di massima importanza per la possibilità di valutare la presenza di lesioni intraparenchimali di aspetto solido o cistico, ricordando che la frequenza di neoplasia testicolare nella popolazione infertile è di circa il 3%. Relativamente alla valutazione delle formazioni solide, lo score di ecogenicità, l’integrazione ECD ed il supporto elastosonografico e/o l’analisi contrastografica della curva di wash-in e wash-out aiutano il clinico nella comprensione di una possibile eziologia neoplastica della lesione.
L’ecografia nelle forme ostruttive
I segni clinici di patologia ostruttiva (congenita o acquisita) più rilevanti sono considerati: la presenza di oligoposia, la ridotta concentrazione di fruttosio nel liquido seminale e pH usualmente acido. Contestualmente sono presenti volume testicolare normali, livelli plasmatici di FSH, inibina B e testosterone totale nella norma, presenza di disturbi eiaculatori di tipo algico e aneiaculazione.
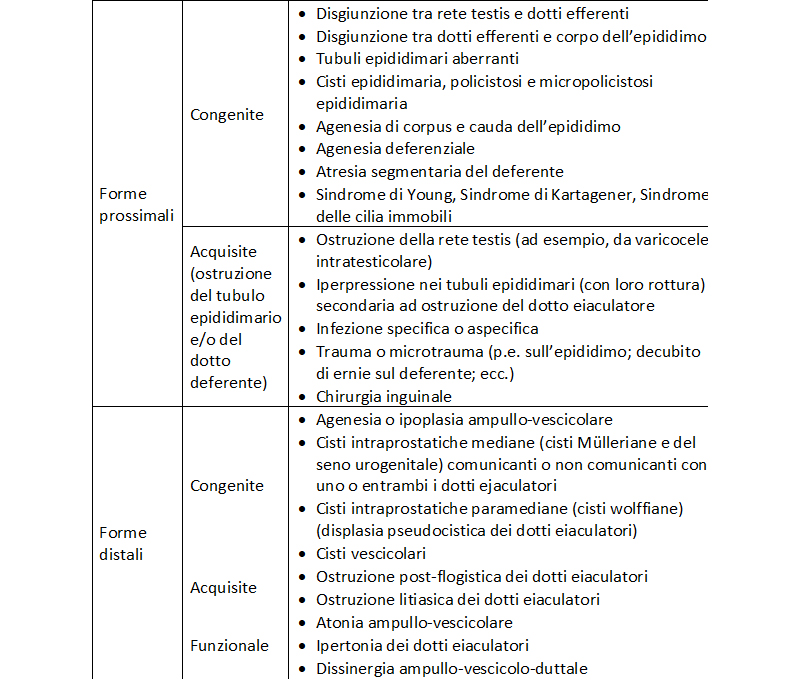
Le ostruzioni vengono classificate in prossimali e distali (Tabella 1). Quelle prossimali interessano le vie seminali intra-testicolari, l’epididimo e il dotto deferente preinguinale. Quelle distali coinvolgono il deferente distale ed il tratto ampullo-vescicolo-duttale. Le ostruzioni complete bilaterali delle vie seminali causano azoospermia e la loro diagnosi è di solito discretamente agevole. Le ostruzioni complete monolaterali o incomplete bilaterali si associano spesso a oligo-asteno-terato-zoospermia e sono piùdifficilmente riconoscibili.
Tra i segni ecografici di ostruzione prossimale, più frequentemente causata dalla presenza di patologia cistica, ricordiamo l’eventuale ectasia della rete testis, la presenza di formazioni cistiche intratesticolari e/o la dilatazione dei dotti epididimari. Alla valutazione ECD, solitamente, queste forme presentano una vascolarizzazione normale. L’agenesia bilaterale dei dotti deferenti, che rappresenta la più comune causa congenita di azoospermia di natura ostruttiva, può essere sospettata quando la parte terminale dell’epididimo (cauda) termina in una struttura nastriforme rudimentale all’esame ecografico scrotale. La TRUS può mettere in evidenza l’assenza dell’ampolla deferenziale o anomalie quali ipoplasia/agenesia delle vescichette seminali o dei dotti eiaculatori. La vasectomia si presenta con dilatazione bilaterale dell’epididimo che assume un aspetto finemente disomogeneo, possono inoltre essere presenti dilatazione della rete testis e cisti intratesticolari. Nelle ostruzioni distali, come in quelle rare dei dotti eiaculatori, la TRUS rivela spesso una dilatazione della porzione prossimale degli stessi, delle vescicole seminali con diametro antero-posteriore >15 mm o dei vasi deferenti con diametro >5 mm.Lesioni prostatiche come le cisti Mülleriane o dell’utricolo, aree anecogene in sede mediana non comunicanti con l’uretra, possono essere difficili da distinguere l’una dall’altra e possono dare ostruzione esercitando compressione sui dotti eiaculatori. Con lo stesso meccanismo possono procurare ostruzione gli ascessi prostatici cronici [7].
Lo studio ecografico della regione didimo-epididimaria e prostato-vescicolare trova, infine, una sua indicazione particolare nella valutazione diagnostica integrata dei pazienti con male accessory gland inflammation (MAGI) consentendo di distinguere le forme non complicate dalle non complicate. Le prime si diagnosticano quando i segni di infiammazione cronica sono limitati alla sola ghiandola prostatica; le seconde si diagnosticano quando i segni di infiammazione cronica sono presenti anche alle vescicole seminali e alla regione epididimaria. Tale classificazione negli anni è stata ritenuta di fondamentale importanza per le differenti ripercussioni sui parametri del liquido seminale che sono di maggiore entità e ingravescenti nelle forme complicate [8; 9].
Conclusioni
La diagnostica ecografica, a basso costo e sicura, può essere di notevole aiuto nel classificare l’infertilità in ostruttiva o secretoria e nell’identificare la causa e la sede dell’eventuale ostruzione. Inoltre, usata di concerto con l’anamnesi, l’esame obiettivo, l’esame del liquido seminale, il quadro ormonale e la diagnostica microbiologica, può essere di grande utilità nell’indirizzare o nel porre la diagnosi.
Tabella 1. Classificazione delle cause di patologia ostruttiva delle vie seminali.