

Costanzo Moretti1 e Giulia Lanzolla2
¹ Divisione di Endocrinologia, Dipartimento di Medicina Sperimentale,
Sezione di Endocrinologia Riproduttiva,
Università di Tor Vergata, Ospedale Fatebenefratelli (San Giovanni Calibita) Roma, Italia.
² Dipartimento di Medicina Sperimentale Sezione di Fisiopatologia Medica,
Scienza dell'Alimentazione ed Endocrinologia
Università di Roma "La Sapienza" 00161 - Roma
INTRODUZIONE
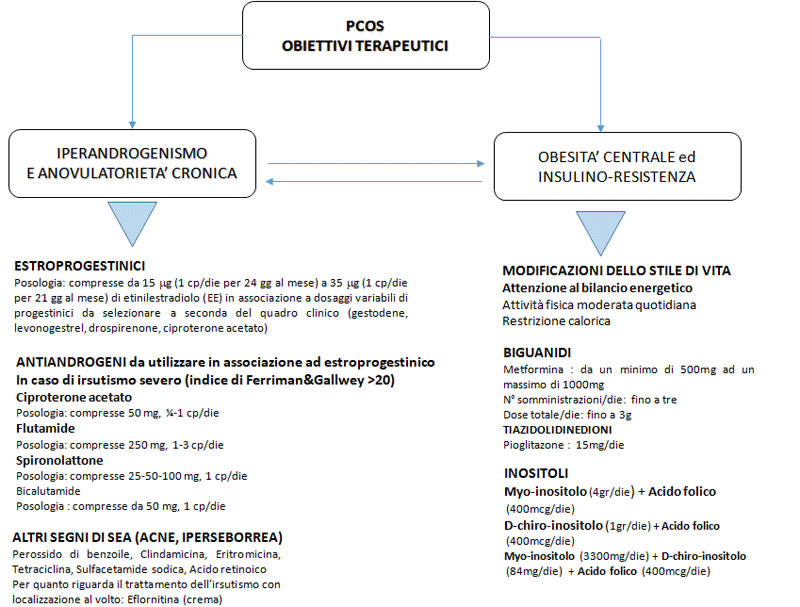
La Sindrome dell’ovaio policistico (PCOS),uno dei disordini endocrini più comuni della donna in età riproduttiva (8-18%), può presentarsi in maniera molto eterogenea, con iperandrogenemia e correlato fenotipo (acne, irsutismo, alopecia), anovulatorietà cronica, oligo-amenorrea, ridotta fertilità e complicanze nel corso di gravidanza. Inoltre, il 22% circa delle pazienti affette da PCOS tendono a sviluppare obesità centrale ed insulino-resistenza, con conseguente iperinsulinemia compensatoria, fattori considerati determinanti nella patogenesi dell’ anovulazione cronica in relazione alle azioni svolte dall’insulina sulle cellule della teca ovarica [1]. Per tali motivi trovano indicazione sostanze insulino-sensibilizzanti quali metformina, pioglitazone ed inositoli, nei protocolli terapeutici sviluppati per curare la sindrome. Gli inositoli (cicloesano-1,2,3,4,5,6), sono polioli ciclici presenti in 9 forme stereoisomeriche, definite dall’orientamento spaziale dei loro sei gruppi idrossilici. Tra queste il myo-inositolo ed il D-chiro-inositolo sono le forme stereoisomeriche più frequentemente rappresentate nell’umano, il primo coinvolto nei meccanismi di assorbimento cellulare di glucosio, il secondo in quelli della sintesi di glicogeno [2,3]. In vivo il D-chiro-inositolo è sintetizzato da una epimerasi che converte myo-inositolo in D-chiro-inositolo. Il myo-inositolo, presente in vari alimenti (cereali integrali, semi, frutta) è la base strutturale del fosfatidil-inositolo, un componente di membrana che a sua volta viene utilizzato per la sintesi di derivati fosforilati, i fosfoinositidi. In breve, le cellule ricavano inositolo da tre fonti : (1) la sintesi de novo a partire dal glucosio 6-fosfato, grazie all’azione della 1-D-myo-inositolo-1-fosfato sintasi (MIPS); (2) la defosforilazione di inositol-fosfati derivati dalla frammentazione di fosfolipidi di membrana contenenti inositolo; (3) l’apporto nutrizionale e l’uptake dal fluido extracellulare attraverso specifici transportatori che possono essere distinti in due gruppi in accordo con il loro meccanismo di accoppiamento al trasporto di sodio o protoni [2,3]. Il myo-inositolo è dunque il maggior componente strutturale del fosfatidil-inositolo, un elemento essenziale della membrana cellulare, a sua volta indispensabile per la sintesi dei fosfoinositidi, coinvolti nella regolazione dei processi di proliferazione e sopravvivenza cellulare, nella regolazione strutturale del citoscheletro, nel metabolismo e nel “trafficking” intracellulare di calcio [4]. Il myo-inositolo è in grado di influenzare anche i processi di osteogenesi ed il mantenimento della densità minerale ossea, nonché la regolazione della funzione riproduttiva femminile e maschile, migliorando la qualità ovocitaria e la maturazione meiotica degli ovociti e la motilità nemaspermica. In sintesi myo-inositolo ed D-chiro-inositolo svolgono un ruolo positivo nella cura della PCOS, sia per la loro azione diretta nel distretto ovarico, sia per l’effetto indiretto esercitato in qualità di agenti insulino-sensibilizzanti [1,3.]
Quando indicata la integrazione con inositoli nella PCOS
Condizioni di iperglicemia ed insulino-resistenza possono essere associate a deplezione intracellulare di inositoli, situazioni in cui la supplementazione con questi composti diviene utile in relazione alle loro proprietà insulino-mimetiche, considerando che essi agiscono attraverso gli stessi meccanismi molecolari attivati dal segnale insulinico e dai farmaci che migliorano la capacità dei tessuti di rispondere all’insulina riducendo il rischio di diabete tipo 2 [4]. Dopo la prima osservazione clinica che ha valutato l’efficacia della somministrazione di 1200 mg/die di D-chiro-inositolo in comparazione con placebo, diversi studi in aperto hanno valutato l’effetto degli inositoli in pazienti obese con PCOS. La somministrazione combinata di myo- e D-chiro-inositolo è dunque in grado di ridurre i livelli plasmatici di insulina ed androgeni migliorando alcuni segni clinici, quali ipertensione e ipertrigliceridemia, associati a sindrome metabolica anche in pazienti normopeso affette da PCOS [5]. Questi risultati non sono però stati confermati utilizzando dosi maggiori di D-chiro-inositolo essendo 2400 mg/die la dose massima da usare per ottenere efficacia clinica. E’ stato in seguito dimostrato che l’assunzione di myo-inositolo (2 gr/die), in associazione con acido folico, in pazienti affette da PCOS con elevato BMI, migliora la sensibilità all’insulina e riduce i livelli plasmatici di ormoni androgeni favorendo la regolarizzazione dei cicli mestruali, con effetti molto simili a quelli ottenuti attraverso l’impiego di altri insulino-sensibilizzanti orali quali la metformina [6]. Una particolare attenzione ha ricevuto il potenziale uso degli inositoli nella procreazione medicalmente assistita (PMA). La presenza di elevate concentrazioni di myo-inositolo nel siero e nel fluido follicolare di pazienti sottoposte a FIVET correla con una migliore qualità oocitaria e con una maggiore percentuale di successo del trattamento. E’ stato inoltre valutato l’effetto che può essere ottenuto mediante somministrazione di acido folico in associazione a myo-inositolo (4 gr/die) piuttosto che D-chiro-inositolo (1 gr/die). Una deplezione di myo-inositolo ed un eccesso di epimerizzazione può dunque essere responsabile della bassa qualità oocitaria in donne affette da PCOS che si sottopongono a PMA [7]. Se però a donne iperinsulinemiche affette da PCOS sottoposte a FIVET, vengono somministrate dosi maggiori di D-chiro-, paradossalmente è stata rilevata una presenza più elevata di oociti immaturi rispetto a quanto si osserva trattando le donne solo con myo-inositolo. Nella gestione della sindrome metabolica e della funzionalità follicologenetica ovarica può essere utile anche un’integrazione combinata di inositoli ed antiossidanti, quali acido α-lipoico e acidi grassi omega3, che possono contribuire al miglioramento della qualità ovocitaria e degli indici di fecondazione. L’acido α-lipoico è un potente antiossidante naturale ed un cofattore enzimatico della catena respiratoria mitocondriale, utile nel mantenimento di un buon controllo glicemico e nel miglioramento di BMI e HOMA index.
L’associazione di mio-inositolo e acido α-lipoico in pazienti affette da PCOS e sottoposte a PMA sembra migliorare i parametri metabolici, il volume ovarico e la qualità ovocitaria ed embrionale incrementando la funzionalità dell’asse riproduttivo ed il grado di fertilità [8]. Queste osservazioni confermano che al fine di ottenere una buona efficacia clinica sulla funzione ovarica, considerando il fatto che l’ovaio non è un organo insulino-resistente, la formulazione di myo-inositolo associata a D-chiro-inositolo (3300mg/84mg) ha un impatto nettamente migliore rispetto alla somministrazione di myo-inositolo o D-chiro-inositolo singolarmente. La migliore supplementazione per donne affette da PCOS è dunque rappresentata dalla combinazione di myo-inositolo e D-chiro-inositolo, in accordo con il rapporto plasmatico fisiologico (40 : 1), allo scopo di ottenere un miglioramento della funzione ovarica. Questa combinazione permette di ottenere risultati molto interessanti ed evita anche alcuni effetti negativi dovuti al solo utilizzo di D-chiro-Inositolo ad alte dosi. E’importante ricordare inoltre che l’inositolo presenta un’azione diretta sulla funzionalità dell'asse riproduttivo femminile grazie al ruolo cardine nella regolazione del rilascio di ioni calcio (Ca2+) durante lo sviluppo degli ooociti e la fase terminale della maturazione ovocitaria. Complessivamente, nell’ambito
dell’iter terapeutico da seguire nelle donne affette da PCOS è consigliabile prendere in considerazione un modello di trattamento che prevede una modificazione dello stile di vita in associazione a supplementazione orale con inositoli in particolare in pazienti con BMI ed HOMA-index aumentati. Nelle pazienti con questo fenotipo è fondamentale ottenere un miglioramento del profilo metabolico per ottimizzare la funzionalità dell’asse riproduttivo. La riduzione della condizione di insulino-resistenza consentirà infatti di migliorare la qualità ovocitaria, la condizione di anovulatorietà cronica, il grado di fertilità e di ridurre il rischio di complicanze in un’eventuale gravidanza.
Fig. 1 – Indicazioni alla integrazione con inositoli nella PCOS – Una volta attuata diagnosi e caratterizzazione del fenotipo PCOS debbono essere considerate le aspettative della paziente. La integrazione con inositoli anche associati ad anti ossidanti (quali omega3 ed acido alfa-lipoico) è utile nel prendersi cura della sindrome metabolica e nel migliorare la funzione follicologenetica ovarica. In caso di programmi terapeutici stabiliti nella procreazione medicalmente assistita, la integrazione con inositoli ed antossidanti può migliorare la qualità oocitaria migliorando gli indici di fecondazione (vedi testo)
Abbreviazioni : SEA Sindrome da Eccesso di Androgeni – T testosterone – FAI free androgen index - Δ4AD Delta4Androstenedione – DHEAS Deidroepiandrosterone Solfato – SHBG Sex Hormone Binding Globuline – AMH Ormone antimulleriano – OA oligoanovulazione - HA iperandrogenismo – mPCO morfologia PCO delle ovaie – CA circonferenza addominale
Riferimenti Bibliografici