Introduzione
Il carcinoma tiroideo (CT) è la neoplasia endocrina più frequente e la sua incidenza è aumentata progressivamente nelle ultime tre decadi in molte regioni del mondo [1]. I carcinomi differenziati della tiroide (CDT) rappresentano circa il 90% dei casi; l’istotipo più frequente è il papillifero che rappresenta circa l'85%, seguito dal follicolare (comprese le varianti a cellule di Hurtle ed insulare) che rappresenta circa il 10%. Raro è invece il carcinoma tiroideo scarsamente differenziato rappresentando meno del 3% di tutti gli istotipi.
Prognosi in relazione al comportamento biologico
Il CDT ha una prognosi molto favorevole nella maggior parte dei casi, con una sopravvivenza del 98-99% in presenza di tumore intratiroideo o con estensione loco-regionale alla diagnosi. La sopravvivenza si riduce tuttavia al 50% circa nei pazienti con metastasi a distanza -
Cancer Facts & Figures 2021 - che si osservano nel 5-10% dei casi.
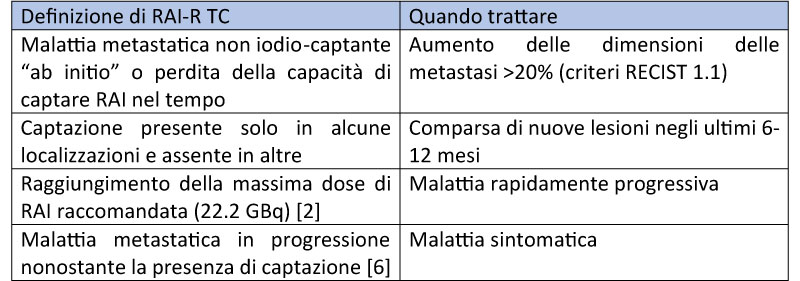
La prognosi dei pazienti con metastasi iodiocaptanti (specie se di piccole dimensioni, quali le localizzazioni miliari polmonari) rimane favorevole ma circa il 60-70% dei pazienti con metastasi a distanza, quindi circa il 5% di tutti i pazienti con CT, sono refrattari allo iodio radioattivo (RAI-R), o “ab initio” o lo divengono durante il follow-up, con un impatto negativo significativo sulla prognosi e un tasso di sopravvivenza a 10 anni di circa il 10%. L’aspettativa di vita media in questi pazienti è di 3-5 anni dalla diagnosi [2-3].
I pazienti con CT RAI-R asintomatici e con malattia stabile richiedono un monitoraggio periodico con tecniche di imaging (in un periodo variabile dai 3 ai 12 mesi in base all’estensione di malattia, alla sede e alla sua aggressività).
Opzioni di terapia in pazienti in progressione di malattia
In tali pazienti (Tabella 1) è necessario valutare altre opzioni terapeutiche che comprendono: i. Trattamenti locali nel caso di malattia oligometastatica e/o sintomatica: metastasectomia di una o poche lesioni (principalmente ossea o polmonare), radioterapia a fasci esterni (EBRT), tecniche interventistiche (vascolari, ablative tra cui radiofrequenza o crioablazione, cementoplastica delle metastasi ossee osteolitiche), ii. Trattamenti sistemici nei casi in cui i trattamenti locali siano controindicati o nei pazienti con malattia metastatica diffusa: inibitori tirosinochinasici (TKI), inibitori selettivi di RET or NTRK o immunoterapia.
La conoscenza dei diversi meccanismi molecolari coinvolti nel processo di oncogenesi ha permesso l’individuazione di molecole che hanno come bersaglio tappe chiave nel processo di sviluppo della neoplasia (target therapy). La rivoluzione di tale terapia sta nel fatto che il tumore venga trattato con terapie basate sull’identikit molecolare e non solo sulla base delle caratteristiche istopatologiche.
Inibitori delle tirosinchinasi (TKI)
I TKI sono delle molecole citostatiche che hanno la capacità di inibire la funzione enzimatica tirosin-chinasica (TK), ed agiscono bloccando sia l’attività dell’oncogene driver sia il processo di neo-angiogenesi tumorale, il quale viene attivato in seguito all’interazione tra fattori di crescita dell’endotelio vascolare (VEGF) e specifici recettori TK (Tabella 2). Tali farmaci sono in grado di bloccare o rallentare lo stimolo cronico della crescita e diffusione tumorale, la quale ricomincia generalmente una volta tolto il blocco.
La decisione sull’inizio della terapia con TKI deve essere condivisa da un team multidisciplinare che valuti per ogni singolo paziente rischi e benefici del trattamento, tenendo conto di età, condizioni generali, numero, sede, dimensioni, velocità di crescita delle lesioni metastatiche e, non ultime, le preferenze del paziente in relazione agli obiettivi terapeutici e all’accettazione di eventuali eventi avversi (EA).
I TKI sono infatti associati a numerosi EA che possono avere un impatto significativo sulle attività quotidiane e sulla continuità della terapia: ipertensione, diarrea, faticabilità, perdita di peso, eritro-disestesia palmo-plantare (sindrome mano-piede), rash cutanei, mucositi, alopecia, proteinuria, aumento del TSH, allungamento del QTc; più raramente sindrome coronarica acuta, trombosi arteriose e venose, emorragie, perforazioni e fistole GI e non GI, encefalopatia tossica. In caso di EA, il dosaggio del farmaco deve essere ridotto, al fine di mantenere un bilancio tra una buona qualità di vita (QoL) e il controllo di malattia. In base al grado di EA (Common Terminology Criteria for Adverse Events, CTCAE) il farmaco va ridotto/sospeso fino al superamento dell’EA, e ripreso a una posologia inferiore.
I risultati di efficacia e di insorgenza di EA derivati da studi clinici controllati sono raramente ripetibili nella vita reale poiché condotti in popolazioni selezionate, in un ambiente controllato e spesso con follow-up di pochi anni.
Pertanto, sono necessari dati nella vita reale per confermare i risultati dei trial randomizzati e per validare ulteriormente l’efficacia e il profilo di sicurezza di questi farmaci [4-5].