Introduzione
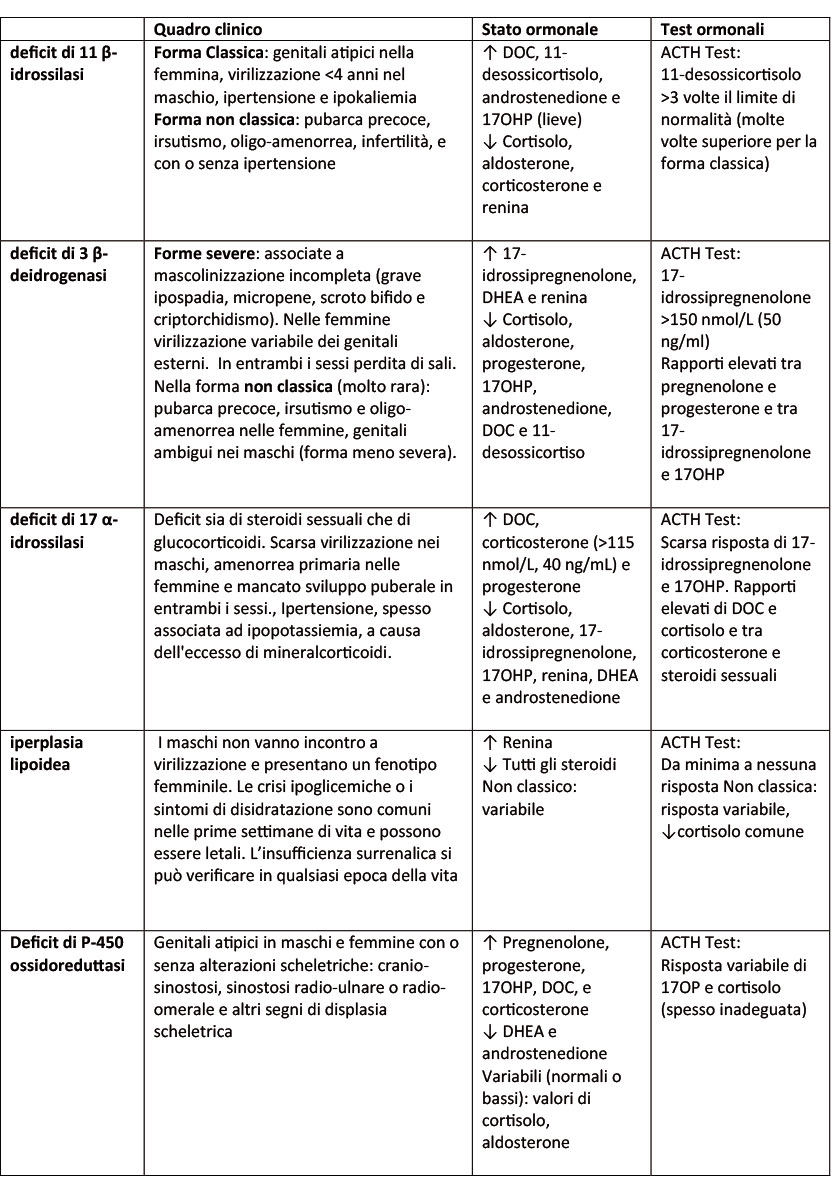
L'iperplasia surrenalica congenita (ISC) include un gruppo di malattie genetiche, a carattere autosomico recessivo, caratterizzate da un difetto enzimatico in una delle tappe coinvolte nella steroidogenesi surrenalica (Figura 1). La conseguenza dei difetti enzimatici è spesso la ridotta biosintesi di cortisolo e quindi una insufficienza surrenalica primitiva. Le modalità di presentazione dell’ISC dipendono dal tipo di difetto genetico e dalla sua gravità ed è in relazione alle carenze ormonali che il difetto stesso comporta, oltre che all’accumulo di precursori a monte del difetto stesso (Tabella 1). Tali difetti hanno degli effetti differenti a seconda del sesso dell’individuo affetto, potendo essere responsabili di disturbi dello sviluppo e della differenziazione sessuale. La forma più comune di ISC (90-95% dei casi) è causata dal
deficit di 21-idrossilasi, dovuto al gene difettivo CYP21A2, situato nel locus 6p21.3, con incidenza 1/1.000-1/10.000. Tale forma, essendo la più comune e la più conosciuta, non verrà trattata in questo articolo, che ha come obiettivo quello di riassumere brevemente le caratteristiche genetiche e cliniche delle forme più rare di ISC.
Classificazione ed Epidemiologia
- Il deficit di 11 β-idrossilasi è responsabile del 5-8% delle forme di ISC, con una incidenza di 1/100.000-1/200.000, ed è dovuto a mutazioni del gene CYP11B1, situato nel locus 8q24.3. L’enzima prodotto determina la conversione dell’11-deossicortisolo in cortisolo e dell’11- deossicorticosterone in corticosterone sotto la regolazione dell’ACTH. La maggior parte delle mutazioni a carico del gene CYP11B1 determina una attività enzimatica minima o assente e quindi risulta in un fenotipo classico. La ridotta sintesi di corticosterone e di cortisolo determina un incremento dei livelli di ACTH ed un eccesso di androgeni che può essere responsabile di ambiguità dei genitali nella femmina e di pseudopubertà precoce nel maschio. In entrambi i sessi, l’eccesso di desossicorticosterone, che ha una debole attività mineralcorticoide, determina ipertensione arteriosa con soppressione del sistema reninaangiotensina - aldosterone.
- Il deficit di 3 β-deidrogenasi è responsabile di circa il 3-4% di tutte le ISC ed è dovuto a mutazioni del gene HSD3B2, situato nel locus 1p13.1. L’incidenza è molto rara e non chiaramente nota. Mutazioni a carico di HSD3B2 determinano una ridotta produzione di aldosterone, cortisolo e androstenedione, con conseguente incremento dei livelli di renina, ACTH e deidroepiandrosterone. Quest’ultimo viene convertito a testosterone dalla 3 β- deidrogenasi di tipo 1, a localizzazione extra surrenalica. I pazienti con questa forma di ISC presentano durante l’infanzia una perdita di sali in entrambi i sessi; i soggetti 46,XY presentano genitali iposviluppati (micropene, ipospadia, scroto bifido e criptorchidismo), mentre i soggetti con cariotipo 46,XX presentano un genere una virilizzazione variabile dei genitali. Le forme non classiche di 3 beta HSD2 esistono, ma sono estremamente rare.
- Il deficit di 17 α-idrossilasi (1-2%) è dovuto a mutazioni del gene CYP17A1, situato nel locus 10q24.3, che codifica per un enzima che esprime sia attività 17 α-idrossilasi che 17,20 liasi. Mutazioni severe di questo gene determinano una ridotta produzione di steroidi sessuali e surrenalici, con conseguente ipogenitalismo e mancata progressione della pubertà. La produzione del deidroepiandrosterone è bloccata, con conseguente assenza di adrenarca e di peluria pubica e ascellare. Il CYP17A1 è espresso nella zona fascicolata e nella zona reticolare, ma non in quella glomerulare. Ciò comporta elevate concentrazioni di desossicorticosterone e corticosterone, con conseguente ritenzione di sodio, ipertensione, ipokaliemia e soppressione della produzione di aldosterone. La presenza di corticosterone, il quale ha una attività glucocorticoide, previene il verificarsi di crisi surrenaliche, nonostante la produzione di cortisolo sia bassa o assente. I genitali hanno un aspetto femminile in entrambi i sessi e tale condizione viene spesso diagnosticata durante l’epoca puberale per una mancata progressione dello sviluppo puberale, con il riscontro di ipogonadismo ipergonadotropo ed ipertensione arteriosa.
- L’Iperplasia lipoidea classica è caratterizzata da una carenza di tutti gli steroidi ed è causata da mutazioni del gene StAR, situato nel locus 8p11.2. L’enzima prodotto regola la sintesi degli ormoni steroidei mediando il trasferimento del colesterolo attraverso la membrana mitocondriale. Questa forma di ISC si presenta in epoca neonatale con crisi surrenalica associata a perdita di sali e genitali femminili in entrambi i sessi. Una forma non classica di iperplasia lipoidea è stata descritta ed è associata ad una attività enzimatica residua di circa il 20-30%, con quadro clinico simile ad una malattia di Addison o ad un deficit di glucocorticoidi familiare.
- Il Deficit di P-450 ossidoreduttasi è una condizione estremamente rara (circa 130 casi nel mondo), spesso associata a malformazioni scheletriche, dovuta a mutazioni del gene POR. Tale gene esercita un ruolo chiave nel trasporto di elettroni nel reticolo endoplasmatico, e diversi enzimi, inclusi 17OH, 21OH e aromatasi, dipendono dal POR per la loro attività catalitica.
Conclusioni
L'ISC da rari difetti enzimatici resta ancora oggi uno dei disturbi endocrini più difficili da diagnosticare, gestire e trattare a causa della variabilità fenotipica, della complessità e della rarità di queste condizioni.
Il quadro clinico-biochimico di queste forme rare di ISC è strettamente correlato al tipo e alla gravità della compromissione enzimatica. In merito al trattamento, esse sono accomunate dalla necessità di un trattamento con glucocorticoidi. In alcune forme può essere necessario un trattamento con mineralcorticoidi, con steroidi sessuali, una terapia antipertensiva ed una correzione chirurgica dei genitali.
I progressi nella genetica e nella metabolomica consentono di diagnosticare più rapidamente anche le forme più rare e di mettere in pratica un trattamento più tempestivo.
Figura 1. Steroidogenesi surrenalica
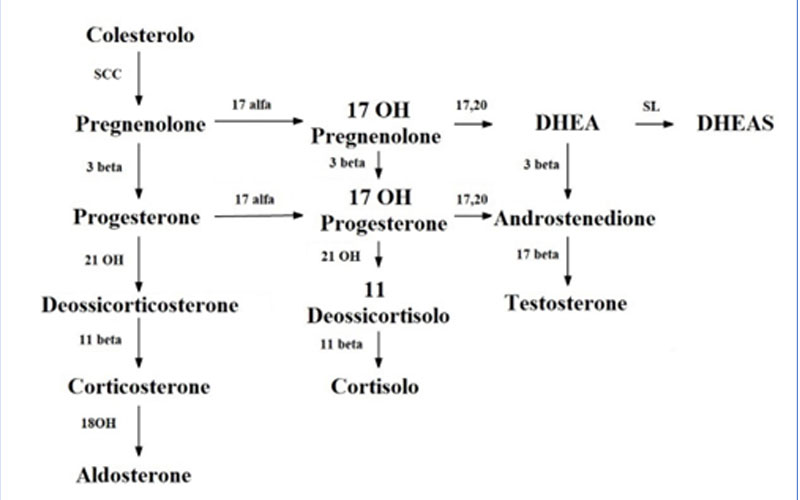 11 beta = 11beta-idrossilasi; 17alfa = 17alfa-idrossilasi; 17,20 = 17,20 liasi; 18 OH = 18-idrossilasi; 21OH = 21-idrossilasi; DHEA = Deidroepiandrosterone; DHEAS = Deidroepiandrosterone solfato; 3beta = 3beta-idrossi-delta5-steroide deidrogenasi; 17beta = 17beta-idrossisteroide deidrogenasi; SCC = Colesterolo monoossigenasi; SL = Solfotransferasi
11 beta = 11beta-idrossilasi; 17alfa = 17alfa-idrossilasi; 17,20 = 17,20 liasi; 18 OH = 18-idrossilasi; 21OH = 21-idrossilasi; DHEA = Deidroepiandrosterone; DHEAS = Deidroepiandrosterone solfato; 3beta = 3beta-idrossi-delta5-steroide deidrogenasi; 17beta = 17beta-idrossisteroide deidrogenasi; SCC = Colesterolo monoossigenasi; SL = Solfotransferasi.
Tabella 1. Quadro clinico e biochimico dei deficit enzimatici rari di iperplasia surrenalica congenita.
 Conflitto di interesse
Conflitto di interesse Gli autori dichiarano di non avere conflitti di interesse.
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana.
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali.
Competing Interests The authors declares no competing interests.
Riferimenti bibliografici
- El-Maouche D, Arlt W, Merke DP (2017) Congenital adrenal hyperplasia. Lancet 390:2194- 2210. doi: 10.1016/S0140-6736(17)31431-9.
- Witchel SF, Azziz R (2011) Congenital adrenal hyperplasia. J Pediatr Adolesc Gynecol 24:116-126. doi: 10.1016/j.jpag.2010.10.001.
- Speiser PW, Azziz R, Baskin LS et al (2010) Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 95:4133-4160. doi: 10.1210/jc.2009-2631.
Scarica Articolo PDF





