Metastasi ossee da carcinoma tiroideo e terapia antiriassorbitiva: come, quando e perché?
Alice Nervo1, Alberto Ragni2, Francesca Retta1
1 Endocrinologia Oncologica, Dipartimento di Oncologia, AOU Città della Salute e della Scienza di
Torino, Torino
2 Endocrinologia e Malattie Metaboliche, AO SS. Antonio e Biagio e Cesare Arrigo, Alessandria
Corrispondenza:
Dott.ssa Alice Nervo
Via Genova 3, 10126 Torino, Italia
Tel: +390116336611
Fax: +390116334703
E-mail: [email protected]
Introduzione
Il carcinoma tiroideo (CT) rientra tra le cinque neoplasie più frequentemente associate a metastasi ossee (MO). Circa il 10% dei pazienti con CT differenziato (CTD) sviluppa MO e quasi la metà dei soggetti con metastasi a distanza presenta un coinvolgimento scheletrico di malattia. Le MO sono più frequentemente riscontrate in caso di istotipo follicolare (7–28%) rispetto a quello papillifero (1–7%); simili percentuali (16–19%) sono state riportate anche per il CT midollare. Il distretto più coinvolto è lo scheletro assiale. Si tratta generalmente di lesioni osteolitiche con formazione ossea secondaria in risposta alla distruzione ossea [1, 2].
Impatto delle MO
La presenza di MO da CT si associa a una ridotta qualità di vita e a un’elevata morbilità, specialmente in caso di insorgenza di eventi scheletrici correlati (skeletal related-events, SRE): fratture patologiche, compressione del midollo spinale, necessità di irradiazione ossea o chirurgia, ipercalcemia maligna. In uno studio, è stata riportata la comparsa di SRE nel 78% di casi di CT con MO e, dopo meno di un anno, il 65% dei pazienti ha sviluppato un secondo SRE [3]. La prognosi dei pazienti con MO da CT è generalmente scarsa, con tassi di sopravvivenza inferiori a quelli osservati nei pazienti con localizzazioni a distanza in altri siti [2].
Meccanismi delle MO
I meccanismi alla base dello sviluppo delle MO sono stati ampiamente indagati negli ultimi anni. Lo scheletro costituisce un bersaglio ideale per la colonizzazione e la proliferazione neoplastica, essendo un deposito di fattori di crescita altamente vascolarizzato. Le cellule tumorali, trasportate dal flusso sanguigno, sono in grado di legare le cellule stromali del midollo e la matrice ossea attraverso specifiche molecole di adesione cellulare, in presenza di un microambiente favorevole. La disregolazione indotta dal tumore della via RANK-RANK ligando-osteoprotegerina sembra essere comune a tutte le neoplasie associate a lesioni osteolitiche; l'attivazione di RANK porta al reclutamento e alla maturazione degli osteoclasti, che inducono il riassorbimento osseo [1].Agendo come potenti inibitori di questo processo, i bisfosfonati (BP) e più recentemente denosumab, anticorpo monoclonale umano diretto contro il RANK ligando, sono stati ampiamente utilizzati per prevenire o ritardare gli SRE nei pazienti con MO da tumori solidi. Le maggiori evidenze in questo setting riguardano i pazienti con carcinoma mammario e prostatico; complessivamente, denosumab sembrerebbe essere più efficace nel ritardare gli SRE rispetto all'acido zoledronico (ZA) [1].
Terapia antiassorbitiva e MO
Gli effetti della terapia antiassorbitiva nei soggetti con MO da CT sono stati valutati in un numero limitato di studi non randomizzati. La somministrazione di pamidronato si è associata a una riduzione del dolore osseo e una migliore qualità di vita. In coorti di pazienti con CTD e MO valutate retrospettivamente, l'incidenza di SRE è risultata significativamente inferiore nei pazienti trattati con ZA rispetto ai soggetti non trattati; inoltre, l'impiego di ZA ha ritardato la comparsa del primo SRE [1, 2, 4].
Tuttavia, l’utilizzo di BP o denosumab sembra ancora limitato nella pratica clinica in questo contesto; secondo uno studio multicentrico retrospettivo di real-life, solamente il 22.4% dei pazienti inclusi aveva ricevuto una terapia anti-riassorbitiva (quasi sempre ZA); si trattava principalmente di pazienti con un precedente SRE [5].
Gli eventi avversi (AEs) associati alla terapia antiriassorbitiva sono generalmente lievi e facilmente gestibili. Dopo la somministrazione endovenosa di ZA, si può verificare una reazione di fase acuta caratterizzata da febbre, artralgie e/o mialgie, di solito autolimitante; la nefrotossicità indotta da BP è direttamente correlata alla dose e al tempo di infusione. Con denosumab sono stati riportati meno reazioni simil-influenzali ed eventi avversi renali, mentre sembra verificarsi più frequentemente l’ipocalcemia; è inoltre stata descritta un’aumentata comparsa di multiple fratture vertebrali alla sospensione del trattamento [1].
L'osteonecrosi della mandibola (ONJ) e le fratture femorali atipiche rappresentano AEs rari ma potenzialmente gravi delle terapie antiriassorbitive. In un recente studio, è stata valutata retrospettivamente una coorte di 23 pazienti con MO da TC trattata con denosumab, per lo più in associazione alla terapia con inibitore multichinasico (MKI); l’ONJ si è verificata nel 26% dei casi [6]. È bene ricordare che anche la terapia con MKI ad azione antiangiogenica è risultata essere associata a insorgenza di ONJ in pazienti con neoplasie solide, anche in assenza di concomitante terapia antiriassorbitiva. È attualmente in corso un trial che valuta l'efficacia di lenvatinib in combinazione con denosumab nel trattamento dei pazienti con CT radioiodio-refrattario (LENVOS; NCT03732495) [1].
Prima dell'avvio dei trattamenti antiriassorbitivi, è necessaria e obbligatoria un’attenta valutazione odontoiatrica, specialmente nei pazienti precedentemente sottoposti a radioterapia a livello del distretto testa-collo e in caso di uso concomitante di MKI. Anche in corso di terapia, è indicato mantenere un’adeguata igiene orale ed eseguire un regolare follow-up odontostomatologico. È inoltre essenziale il mantenimento di adeguati livelli di vitamina D e calcio, sia per garantire l’effetto benefico a livello osseo sia per prevenire l'ipocalcemia, soprattutto nei pazienti con ipoparatiroidismo post-chirurgico [2].
Lo schema ottimale di somministrazione della terapia antiriassorbitiva in termini di frequenza di somministrazioni e durata di trattamento è tuttora oggetto di discussione. Nelle pazienti con MO da tumore mammario, non è stata osservata alcuna differenza in termini di comparsa di SRE tra la somministrazione ogni 4 settimane rispetto a quella effettuata ogni 12 settimane [1]. Al momento non esistono studi riguardanti la popolazione con MO da CTD che definiscano la strategia più opportuna per prevenire l’insorgenza di SRE minimizzando la potenziale tossicità dei trattamenti.
Conclusioni
Le MO sono frequentemente riscontrate nei pazienti con CT avanzato e si associano a ridotta qualità della vita, elevata morbilità e mortalità, specialmente nel caso di insorgenza di SRE. Il razionale dell’impiego della terapia antiriassorbitiva (soprattutto ZA o denosumab) si basa sulle evidenze estrapolate da studi effettuati su altri tumori solidi, mentre i dati a disposizione nel contesto del CT riguardano un numero limitato di pazienti. Sono necessari futuri studi prospettici per ottimizzare la gestione del trattamento antiriassorbitivo nei pazienti con MO da CT, in particolare sui temi ancora dibattuti (ad es. intervallo tra le somministrazioni, durata complessiva della terapia).
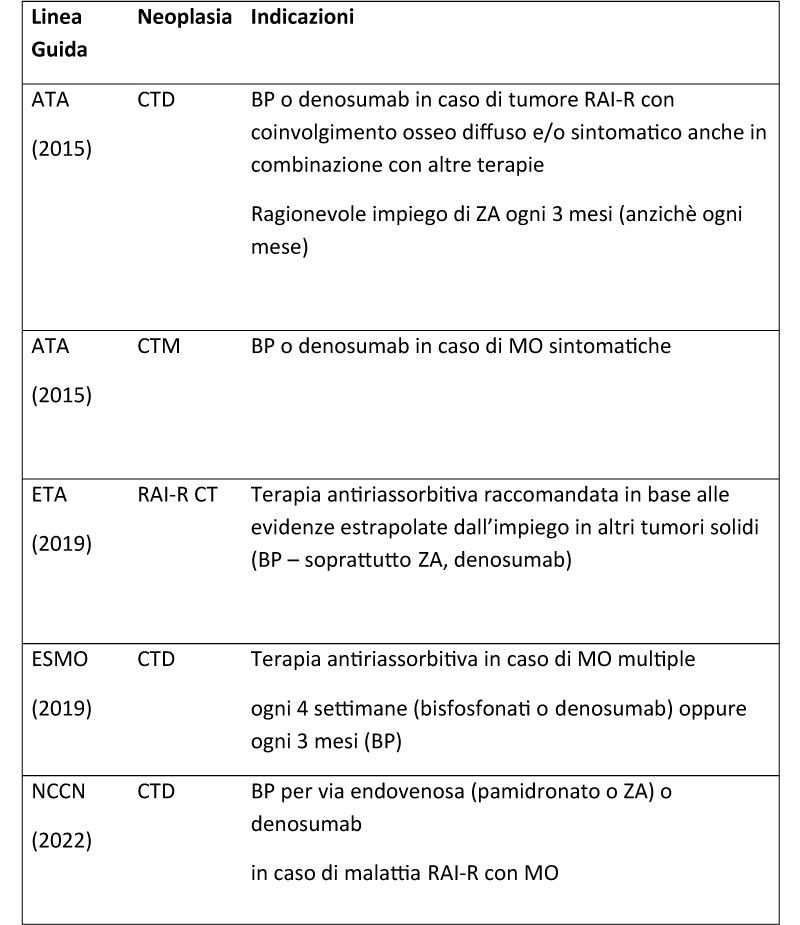
Tabella 1. Indicazioni fornite dalle principali linee guida relative al CT sulla terapia
antiriassorbitiva nei pazienti con MO.
Abbreviazioni. ATA: American Thyroid Association; BP: bifosfonati; CTD: carcinoma tiroideo differenziato; ESMO: European Society for Medical Oncology; ETA: European Thyroid Association; MO: metastasi ossee; CTM: carcinoma tiroideo midollare; NCCN: National Comprehensive Cancer Network; RAI-R: radioiodio-refrattario; CT: carcinoma tiroideo; ZA: acido zoledronico
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana.
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Adrogué HJ, Tucker BM, Madias NE. Diagnosis and Management of Hyponatremia: A Nervo A, Ragni A, Retta F, et al. Bone metastases from differentiated thyroid carcinoma: current knowledge and open issues. J Endocrinol Invest. 2021;44(3):403-419.
- Iñiguez-Ariza NM, Bible KC, Clarke BL. Bone metastases in thyroid cancer. J Bone Oncol. 2020;21:100282.
- Farooki A, Leung V, Tala H, et al. Skeletal-related events due to bone metastases from differentiated thyroid cancer. J Clin Endocrinol Metab. 2021; 97(7):2433–2439.
- Orita Y, Sugitani I, Toda K, et al. Zoledronic acid in the treatment of bone metastases from differentiated thyroid carcinoma. Thyroid. 2011;21(1):31–35.
- Mazziotti G, Formenti AM, Panarotto MB, et al. Real-life management and outcome of thyroid carcinoma-related bone metastases: results from a nationwide multicenter experience. Endocrine. 2018; 59(1):90–101.
- Wassermann J, Mathy E, Lescaille G, et al. Safety of denosumab in patients with refractory differentiated thyroid cancer and advanced medullary thyroid cancer. J Clin Oncol. 2019; 37(15_suppl):e17578–e17578.
Scarica Articolo PDF