M. Bonomi1,2, M. Amer2, A. Amodeo2, E. Munari2, C. Manzini2, B. Cangiano1,2
1Dipartimento Endocrino-Metabolico, Istituto Auxologico Italiano IRCCS, Milano, Italia
2Dipartimento di Biotecnologie Mediche e Medicina Traslazionale, Università degli Studi di Milano, Milano, Italia
Corrispondenza: Prof. Marco Bonomi Istituto Auxologico Italiano IRCCS – Ospedale San Luca
Piazzale Brescia 20 – 20149 Milano, Italia
Mail: [email protected]; [email protected]
Introduzione
L'ipogonadismo secondario o centrale (IC) è caratterizzato da ridotti livelli circolanti di testosterone (T) e bassi/inappropriatamente normali di ormone luteinizzante (LH) e follicolo-stimolante (FSH). Le cause di IC possono essere organiche o funzionali (Figura 1A), una distinzione che ha importanti implicazioni cliniche. L'IC organico è causato da un disturbo congenito o acquisito caratterizzato da una disfunzione ipotalamica e/o ipofisaria permanente. Al contrario, l'ipogonadismo funzionale è causato da condizioni che sopprimono/inibiscono la secrezione di gonadotropine e conseguentemente di T, ma che sono potenzialmente reversibili con il trattamento della causa eziologica sottostante (1). Il quadro clinico del paziente con IC varia a seconda dell’epoca di insorgenza del difetto (Figura 1B) e in base all’eventuale presenza di altri deficit ipotalamo-ipofisari associati. In particolare, nel paziente adulto con IC, sarà generalmente compromessa non solo la produzione ormonale testicolare ma anche la spermatogenesi che sono peraltro due funzioni strettamente correlate. Infatti, una ridotta secrezione di T circolante comporterà anche la sua ridotta concentrazione intra-testicolare che è fondamentale per la regolare spermatogenesi unitamente allo stimolo di FSH che in questi pazienti è parimenti ridotto. L’infertilità legata alle forme di IC risulta, tuttavia, nella maggior parte dei casi trattabile (2).
Induzione della fertilità nel maschio con IC
La fertilità in uomini con IC può essere indotta con differenti approcci volti a riprodurre la regolazione ormonale della spermatogenesi. I protocolli ad oggi disponibili prevedono terapia con GnRH (ormone di rilascio delle gonadotropine) pulsatile o gonadotropine esogene (2-3). Il primo è inefficace in pazienti con IC di tipo ipofisario ma è altresì raramente utilizzato per la scarsa disponibilità del farmaco, la scarsa tollerabilità da parte del paziente e il costo del trattamento che, peraltro, non presenza reali vantaggi rispetto alla terapia con gonadotropine esogene. Pertanto, l’approccio terapeutico più utilizzato è quello con gonadotropine esogene. Sono disponibili preparazioni iniettabili di FSH (highly purified urinary FSH; human menopausal gonadotropin hMG; o FSH umano/ricombinante), di LH (LH ricombinante umano) e di hCG (gonadotropina corionica umana) come analogo di LH. Sulla base della storia e delle caratteristiche cliniche del paziente, il medico potrà orientarsi tra vari schemi terapeutici (Tabella 1). L’uso di hCG in monoterapia è adatto a pazienti con esordio di ipogonadismo in età adulta e normale sviluppo puberale e testicolare. Con questo approccio, generalmente, si ottiene la fertilità indicativamente entro sei mesi. Se dopo tale periodo la conta spermatica rimane insoddisfacente, nonostante compliance e posologia adeguate, è possibile aggiungere FSH. Tuttavia, questa strategia terapeutica raramente avrà successo in pazienti con IC congenito, per i quali l’impostazione con la terapia combinata FSH+hCG è indicata fin dalle fasi iniziali. In questi pazienti è stato proposto anche uno schema sequenziale, in fase di induzione puberale, che prevede un pretrattamento con solo FSH al fine di massimizzare la numerosità delle cellule del Sertoli e lo sviluppo dei tubuli seminiferi prima della maturazione testosterone-dipendente indotta dall’hCG, che viene introdotto solo dopo 2-4 mesi (4-5).
Va sottolineato che la terapia a base di FSH è rimborsata dal SSN (Sistema Sanitario Nazionale) secondo nota AIFA (Agenzia Italiana del Farmaco) 74 (
https://www.aifa.gov.it/nota-74), in caso di maschi con ipogonadismo ipogonadotropo con livelli di gonadotropine bassi o normali e comunque con FSH non superiore a 8 mUI/ml, mentre nei casi di IC congenito, appartenenti al gruppo delle malattie rare, la prescrizione di tali farmaci è rimborsata dal SSN in presenza di piano terapeutico rilasciato da centro autorizzato.
Nei pazienti in terapia sostitutiva con testosterone, è indicata la sospensione del trattamento con un sufficiente anticipo in relazione all’emivita della formulazione.
Un volume testicolare al baseline indicativo di una pregressa parziale (4-12 mL) o normale maturazione testicolare (>12 mL), livelli circolanti di inibina B indicativi di un’adeguata popolazione di cellule del Sertoli (> 60 pg/mL), e un’anamnesi negativa per criptorchidismo, rappresentano fattori predittivi positivi rispetto all’induzione della spermatogenesi. Il mancato raggiungimento di una concentrazione spermatica nel range di riferimento riportato dall’Organizzazione Mondiale della Sanità (≥16 milioni/mL), inclusi i quadri di oligospermia severa (<5 milioni/mL), non preclude comunque la possibilità di concepimento.
Nei pazienti in trattamento per induzione della fertilità è indicato eseguire un adeguato follow-up con esami ematici ogni 4-6 settimane, per l’eventuale modifica della posologia, e lo spermiogramma ogni 2-3 mesi. I più comuni effetti collaterali da monitorare in corso di follow-up includono eritrocitosi e ginecomastia.
Poiché l’induzione della spermatogenesi e il successivo raggiungimento di una gravidanza naturale possono richiedere anche tempi dilatati, soprattutto per le forme di IC congenito, può essere considerato il ricorso alla procreazione medicalmente assistita (PMA) soprattutto se sussistono fattori di urgenza, come ad esempio l’età della partner (≥35 anni). È generalmente consigliato proseguire la terapia con gonadotropine fino almeno al secondo trimestre di gravidanza, per mantenere la fertilità in caso di aborto spontaneo.
Prima dell’interruzione del trattamento con gonadotropine e il passaggio alla terapia sostitutiva con testosterone, va considerata la possibilità di crioconservazione dello sperma in caso di desiderio di successive gravidanze.
Inoltre, si raccomanda counseling genetico in pazienti affetti da IC congenito con desiderio di fertilità in considerazione della possibile di trasmissione del difetto genetico (2-3,6).
Fig.1: Cause e quadri clinici di ipogonadismo ipogonadotropo
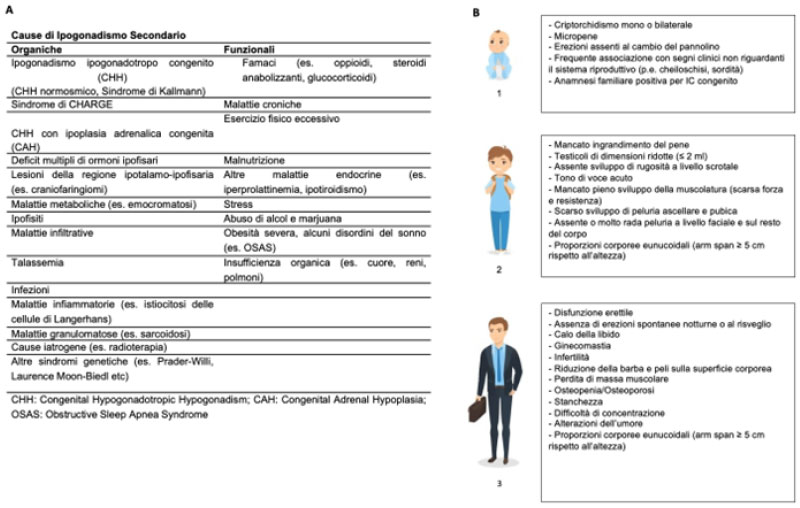 Tabella1:
Tabella1: Schema terapeutico per l’induzione della fertilità nell’ipogonadismo ipogonadotropo




