Gestione degli edemi ossei nella pratica clinica
Fabio Malacarne1, Antonino Catalano1,2
1Scuola di Specializzazione in Geriatria, Università di Messina, Messina, Italia
2Unità Operativa di Geriatria, Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di
Messina, Messina, Italia.
Autore corrispondente: A. Catalano [email protected]
Introduzione
L’edema osseo è espressione di danno locoregionale del sistema muscoloscheletrico che si manifesta come un’alterata captazione di segnale alla risonanza magnetica nucleare. Può caratterizzare il decorso clinico di patologie osteomuscolari: traumatiche (frattura da fragilità e non), degenerative (osteoartrite), infiammatorie (artropatia o entesiti), vascolari (algodistrofia), infettive (osteomielite), metaboliche (artropatie da deposizione di cristalli) e neoplastiche. Può, inoltre, riconoscere un’eziologia iatrogena (esito di interventi di chirurgia locale o radioterapia)1. L’edema osseo si accompagna spesso a sintomatologia algica e nella maggior parte delle “sindromi da edema osseo” ha un’evoluzione clinica autolimitante. Tuttavia, nella sindrome algodistrofica è possibile un’evoluzione verso la disabilità permanente.
La sindrome Algodistrofica
La Sindrome Algodistrofica (SA) comprende una varietà di quadri clinici caratterizzati da dolore cronico locoregionale che può associarsi a: manifestazioni sensoriali, motorie, vasomotorie e sudomotorie, rigidità articolare ed osteoporosi. Viene identificata con l’acronimo CRPS (Chronic Regional Pain Syndrome) e classicamente suddivisa in due forme:
- CRPS-I che riconosce come noxa patogena un evento nocivo (come un trauma meccanico o la chirurgia) a carico di un distretto osseo con risparmio dei tessuti nervosi
- CRPS-II che si verifica a seguito del danno di un nervo periferico
La CRPS-I viene classificata, in base alle caratteristiche della cute al termotatto al suo esordio, in
Calda (in genere a migliore prognosi) e
Fredda (peggiore prognosi).
A tutt’oggi non è chiaro se il decorso naturale della forma calda possa prevedere l’atrofia tissutale (osso, derma, epidermide, vene) associata a severa sintomatologia algica ed evoluzione verso la forma fredda. Tuttavia, nei casi osservati di CRPS fredda, i pazienti non riferiscono una vera e propria fase calda. Pertanto, è ipotizzabile che le due forme rappresentino due diverse entità nosologiche che richiedono due diversi interventi terapeutici
2.
La SA rappresenta una patologia di pertinenza specialistica trasversale e proprio per la sua non agevole identificazione iniziale i dati epidemiologici sono frammentari stimandosene un’incidenza variabile da 5 a 26 casi per 100,000 persone/anno
2.
Diagnosi
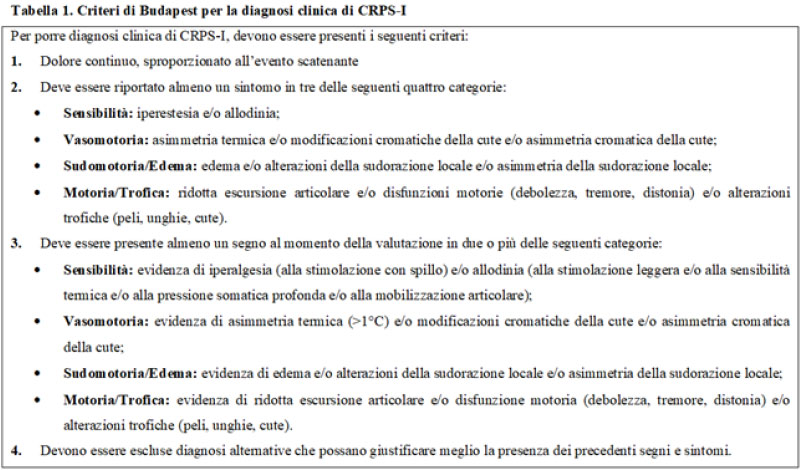
L’inquadramento diagnostico della CRPS-I si basa sul colloquio anamnestico e sull’obiettività clinica. I “Criteri di Budapest” [Tabella 1] condensano questi dati nel più frequente algoritmo diagnostico per la CRPS-I e pertanto rappresentano il modello a cui fare riferimento. Tuttavia, nella definizione diagnostica della patologia le alterazioni scheletriche non vengono incluse, nonostante il danno del tessuto osseo, segnatamente l’edema, rappresenti un elemento del quadro clinico già presenta all’esordio nella maggior parte dei casi precocemente riconosciuti. Frequentemente nella pratica clinica ci si imbatte, altresì, in un bias diagnostico determinato dalla tendenza di molti radiologi a definire erroneamente un quadro clinico come “algodistrofico” sulla base della sola rilevazione di un alterato segnale alla RMN compatibile con edema osseo, seppur non accompagnato da sintomatologia e/o segni clinici che soddisfino i criteri di Budapest..
Il ruolo della diagnostica strumentale può essere schematizzato considerando le seguenti 3
metodiche:
- Radiologia convenzionale: le cui immagini possono rilevare quadri privi di specificità e soltanto ad un mese dall’esordio dei sintomi;
- Scintigrafia ossea: le cui sensibilità, specificità e predittività diagnostica superano le altre metodiche. Tuttavia, possiede minor utilità negli stadi più avanzati della patologia;
- Risonanza Magnetica Nucleare: utile in tutte le fasi evolutive della malattia grazie alla capacità di studio dei tessuti molli e quindi alla possibilità di documentare l’edema e l’atrofia.
Gestione terapeutica
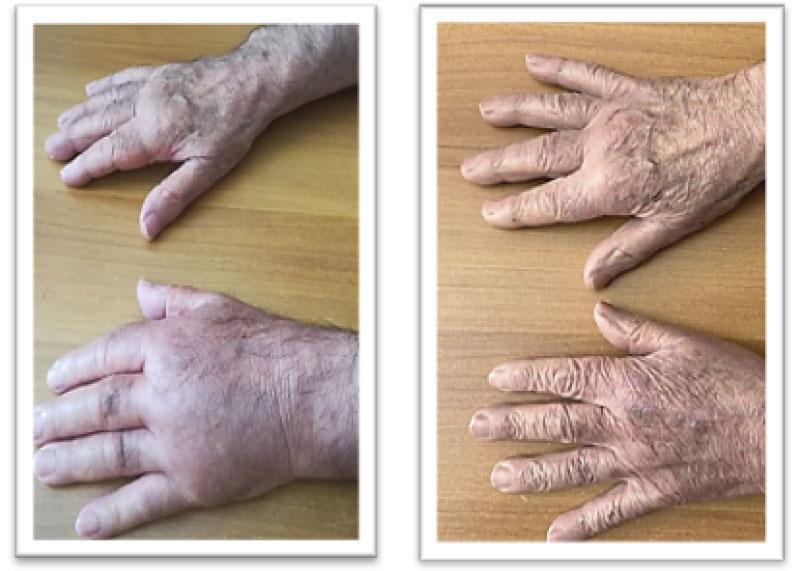
In passato, numerose opzioni sono state considerate per il trattamento farmacologico della CRPS-1: farmaci anticonvulsivanti, antidepressivi ed oppioidi non hanno dimostrato efficacia sulla gestione del dolore; mentre, glucocorticoidi, farmaci antinfiammatori non steroidei ed infusioni endovenose di immunoglobuline hanno prodotto risultati terapeutici non soddisfacenti2. Dal 2013, grazie ad uno studio randomizzato controllato in doppio-cieco3, è stata approvata la terapia con neridronato (la dose raccomandata è di 100 mg e.v. al giorno ogni 3 giorni per un totale di 400 mg di neridronato, somministrati in infusione endovenosa lenta previa diluizione in soluzione fisiologica). Il follow-up a 40 giorni documentava una significativa riduzione dell’edema osseo e del dolore, valutato secondo la scala VAS3 [Figura 1]. Un ulteriore studio randomizzato controllato in doppio-cieco4 ha dimostrato che i pazienti affetti da CRPS-1 trattati con un’iniezione intramuscolare quotidiana di neridronato 25 mg per 16 giorni consecutivi godevano di un beneficio terapeutico praticamente sovrapponibile a quello ottenuto con la terapia per via endovenosa4. Inoltre, in uno studio di estensione a 12 mesi, si dimostrava la persistenza del beneficio clinico ottenuto con neridronato, indipendentemente dalla via di somministrazione5, e si confermava la remissione permanente della malattia, il controllo del dolore e la prevenzione della disabilità.
Figura 1 CRPS-1 prima (A) e dopo 40 giorni (B) in un paziente trattato con neridronato
.
Conflitto di interesse Gli autori dichiarano di non avere conflitti di interesse.
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana.
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Competing Interests The authors declares no competing interests.
Riferimenti bibliografici
- Manara M, Varenna M. A clinical overview of bone marrow edema. Reumatismo 2014 Jul 28; 66(2):184-96. doi: 10.4081/reumatismo.2014.790. PMID: 25069499
- Gatti D, Rossini M, Adami S. Management of patients with complex regional pain syndrome type I. Osteoporos Int 2016 Aug; 27(8): 2423-31. doi: 10.1007/s00198-016-3531-9. Epub 2016 Feb 29. PMID: 26928187.
- Varenna M, Adami S, Rossini M, Gatti D, Idolazzi L, Zucchi F, Malavolta N, Sinigaglia L. Treatment of complex regional pain syndrome type I with neridronate: a randomized, double-blind, placebo-controlled study. Rheumatology (Oxford) 2013 Mar; 52(3): 534-42. doi: 10.1093/rheumatology/kes312. Epub 2012 Nov 30. PMID: 23204550.
- Varenna M, Braga V, Gatti D, Iolascon G, Frediani B, Zucchi F, Crotti C, Nannipieri F, Rossini M. Intramuscular neridronate for the treatment of complex regional pain syndrome type 1: a randomized, double-blind, placebo-controlled study. Ther Adv Musculoskelet Dis 2021 Jun 11; 13:1759720X211014020. doi: 10.1177/1759720X211014020. PMID: 34178124; PMCID: PMC8202309.
- Varenna M, Gatti D, Zucchi F, Crotti C, Braga V, Iolascon G, Frediani B, Nannipieri F, Rossini M. Long-term efficacy and safety of neridronate treatment in patients with complex regional pain syndrome type 1: a pre-specified, open-label, extension study. Ther Adv Musculoskelet Dis 2022 Dec 19; 14:1759720X221142274. doi: 10.1177/1759720X221142274. PMID: 36569491; PMCID: PMC9772942.
Scarica Articolo PDF



