Roberta Modica1, Elio Benevento1, Annamaria Colao1,2
1Dipartimento di Medicina Clinica e Chirurgia, UOC Endocrinologia Diabetologia e Andrologia - Università degli Studi di Napoli Federico II 2Cattedra UNESCO per l'Educazione alla Salute e lo Sviluppo Sostenibile, Università Federico II, Napoli, Italia Corresponding Author Roberta Modica, Dipartimento di Medicina e Chirurgia, Unità di Endocrinologia, Diabetologia, Andrologia – Università degli Studi di Napoli Federico II 338-5264109 [email protected]
Introduzione
I tumori neuroendocrini (NET) sono tumori rari ad incidenza in aumento (6,98/100.000) con possibile insorgenza in ogni distretto dell’organismo, prevalentemente nel tratto gastro-enteropancreatico e bronchiale (1). La maggior parte dei NET sono ben differenziati e a lenta crescita, tuttavia in circa il 40-50% dei pazienti la malattia è già metastatica alla diagnosi e tra il 10 e il 20% dei casi non è possibile individuare la lesione primitiva (unknow primary origin, UPO) con la diagnostica iniziale di primo livello (2). La presenza di un primitivo ignoto (NET UPO) esclude a priori la resecabilità del tumore e può impedire l’avvio di trattamenti specifici. Anche per questi motivi la prognosi del paziente NET UPO è peggiore rispetto a pazienti metastatici ma con primitivo noto (11 vs 19 mesi) (3).
Esami diagnostici
La maggior parte dei NET sono non funzionanti, ma la presenza di segni clinici da ipersecrezione ormonale può rappresentare una possibilità per la ricerca della sede del primitivo, adattando gli esami biochimici da richiedere in base alla sindrome sospettata (Tabella 1) (4). Laddove la diagnostica morfologica iniziale di primo livello non consenta l’individuazione del primitivo, la diagnostica funzionale con 68-GaDOTATOC PET/TC può identificare anche lesioni di piccole dimensioni, altrimenti misconosciute, in presenza di un forte sospetto clinico. È stata riportata una riduzione dal 26% al 11% di NET UPO dopo 68-GaDOTATOC PET/TC e la maggior parte dei primitivi era identificata nel piccolo intestino o duodeno (47,5%), seguiti da retto (20%) e pancreas (17,5%) (3,5). Per il piccolo intestino la video-capsula ha mostrato, su una piccola serie di pazienti di diagnosi già nota, una sensibilità del 60% e una specificità del 100% (3). L’identificazione del primitivo può avvenire anche tramite esplorazione chirurgica, con identificazione più spesso al piccolo intestino (70%) e pancreas (3%), raramente (2% e l’1%) di pertinenza rettale ed ovarica (3).
Il ruolo della biopsia
La diagnosi di NET UPO si ottiene principalmente su campione bioptico da metastasi periferica, principalmente localizzate a fegato, peritoneo, linfonodi e meno frequentemente all’osso e al polmone (3). La possibilità di effettuare indagini immunoistochimiche estese su prelievi bioptici può orientare la ricerca del primitivo, sebbene l’espressione dei marcatori possa variare, specie in tumori poco differenziati (Tabella 2, Figura 1) (6). Più recentemente è stato ipotizzato che 3 geni compresi in un pannello di 1760 possano predire la primitività. Infatti, se il CD302 era up-regolato per più di 13 volte rispetto al valore limite, il primitivo era considerato ileale; se PPWD1 era down-regolato con valori sotto 3 volte il limite, era considerato pancreatico; se ABHD14B era up-regolato per più di 4 volte rispetto al limite, il primitivo era gastrico (7). Ad uno studio retrospettivo di campioni già analizzati e con diagnosi già nota, CD302 come marker ha mostrato una sensibilità del 94% e specificità del 90% per gli ileali, mentre PPWD1 ha sensibilità dell’83% e specificità del 100% per i pancreatici; inoltre per questi due markers è stato anche validato l’esame immunoistochimico che, sebbene di più semplice esecuzione, ha sensibilità inferiore (80%) (7).
Trattamento
Oltre al trattamento delle sindromi funzionali, la possibilità di impostare una terapia specifica in pazienti con NET UPO può migliorare la sopravvivenza (9). In un sottogruppo dello studio RADIANT- 4, pazienti con NET UPO non funzionanti trattati con everolimus avevano una PFS media di 13,6 mesi vs 7,5 trattati con placebo (10). In pazienti NET UPO con 68-GaDOTATOC PET/TC positiva, la terapia con 177Lu-DOTATATE è considerabile, anche se è stata mostrata una risposta secondo criteri RECIST peggiore in pazienti UPO vs pazienti a primitivo noto (71,4% vs 83,7%) (11). Altra possibilità sono schemi chemioterapici a base di temozolomide, dimostrati efficaci in NET di diverse origini, specie se con Ki-67<55%. In caso di forme scarsamente differenziate con Ki-67>55% sono invece consigliabili schemi a base di platino (cisplatino o carboplatino) ed etoposide (3).
Conclusioni
La ricerca del primitivo in presenza di un NET metastatico deve sempre essere perseguita al fine di avviare un trattamento individualizzato. Le indagini morfologiche devono essere ripetute nel tempo e affiancate da quelle funzionali, in particolare la 68-GaDOTATOC PET/TC. Gli esami biochimici devono essere orientati dalla presentazione clinica e la biopsia su metastasi fornisce la possibilità di indirizzare la ricerca della sede del primitivo attraverso il profilo immunoistochimico. La terapia, analogamente ai casi di primitivo noto, dipende principalmente dalle caratteristiche biologiche, dal Ki67 e dall’impegno metastatico. Il miglioramento delle tecniche diagnostiche e di profilazione molecolare potrà ridurre la prevalenza di NET UPO e aumentare la sopravvivenza dei pazienti.
Tabella 1 Sindromi funzionanti, sintomi, markers biochimici e sede del tumore primitivo
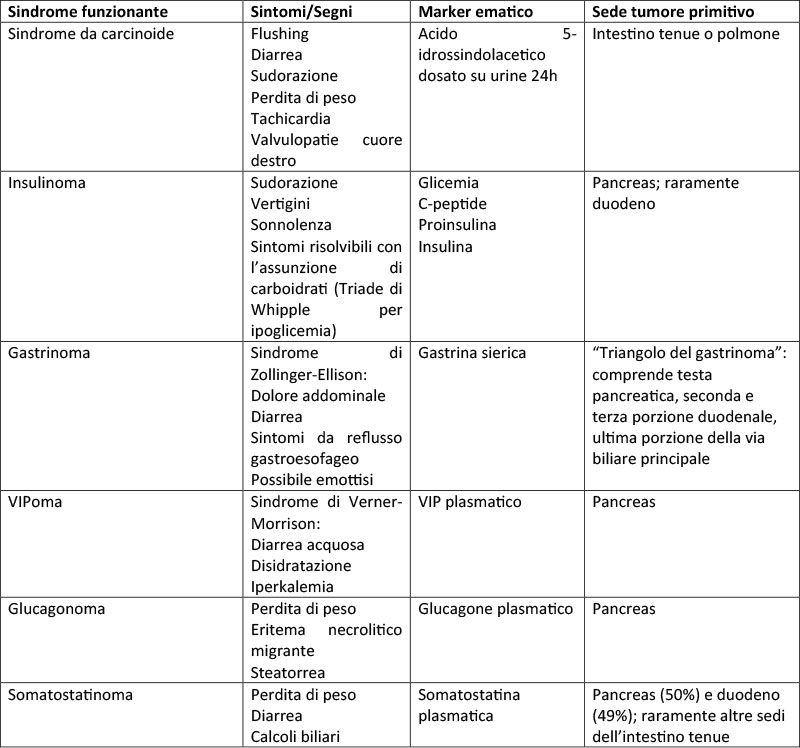 Tabella 2 Markers immunoistochimici
CgA
Tabella 2 Markers immunoistochimici
CgA: Cromogranina A;
Syn: Sinaptofisina;
ISL1: Insulin Gene Enhancer Binding Protein Isl-1;
INSM1: INSM transcriprional repressor 1;
TTF1: Thyroid transcription factor-1;
PDX1: pancreatic and duodenal homeobox 1;
CDX2: Caudal Type Homebox 2;
NESP55: Neuroendocrine secretory protein 55;
ATRX/DAXX: alfa talassemia, ritardo mentale X-linked/proteina associata a death-domain;
PAX6: Paired box gene 6;
PAX8: Paired box gene 8; SATB2: Proteina binding ricca in sequenze AT tipo 2;
CK20: Citocheratina 20;
GATA3: GATA Binding Protein 3; si consideri che * possono essere persi nei de-differenziati
.
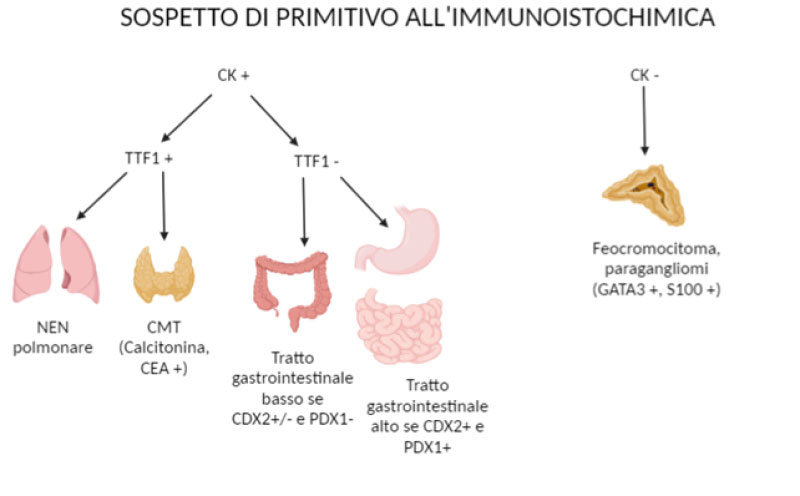
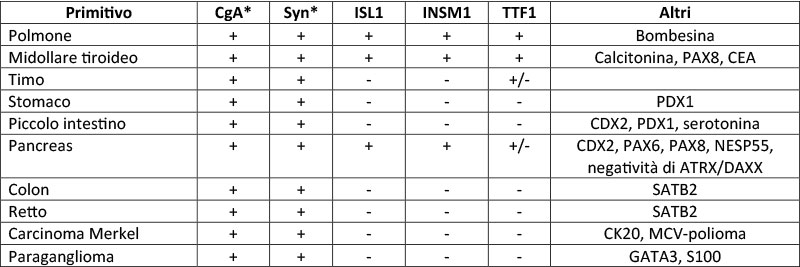 Figura 1 NET-UP: Algoritmo diagnostico basato su immunoistochimica.
CK
Figura 1 NET-UP: Algoritmo diagnostico basato su immunoistochimica.
CK: pancitocheratine.
TTF1: Thyroid transcription factor 1;
PDX1: pancreatic and duodenal
homeobox 1;
CDX2: Caudal Type Homebox 2;
GATA3: GATA Binding Protein 3