Valeria Cambria, Chiara Bona, Valentina Gasco
SCDU Endocrinologia, Diabetologia e Metabolismo, Dipartimento di Scienze Mediche, Università di Torino, Torino, Italia
Corrisondenza
Valentina Gasco
SCDU Endocrinologia, Diabetologia e Metabolismo
Dipartimento di Scienze Mediche
Città della Salute e della Scienza di Torino
c.so Dogliotti 14
10126 Torino
Tel 011.6334317
Fax 011.6647421
mail [email protected]
Introduzione
Gli ormoni ipofisari sono essenziali per la fertilità e la gravidanza. Anche in presenza di un asse gonadico intatto, il deficit dei restanti assi ipofisari può influenzare la fertilità avendo un effetto diretto sulla funzione dell’ovaio [1] e correlando con una ridotta fertilità. Lo sviluppo di tecniche di riproduzione assistita ha incrementato la probabilità di gravidanza nelle donne ipopituitariche (47-76%) [1] con un tasso di natalità del 42% [2].
La gravidanza fisiologica si accompagna a variazioni ormonali indotte in massima parte dalla placenta, organo endocrino transitorio in grado di determinare variazioni morfo-funzionali nell’ipofisi materna [1] (Fig 1). Nella donna ipopituitarica la risposta adattativa dell’ipofisi non è sempre adeguata e ciò ha reso necessario affrontare il problema della terapia sostitutiva per assicurare i migliori esiti materno-fetali.
Ipocorticosurrenalismo secondario
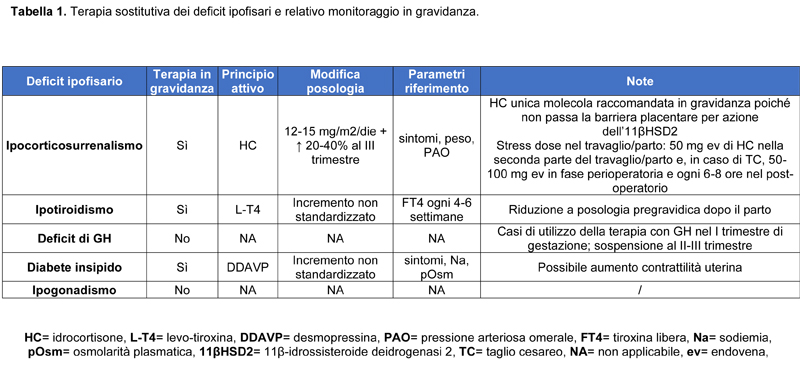
La terapia sostitutiva surrenalica, imprescindibile per la sopravvivenza, deve proseguire in gravidanza, cercando un equilibrio tra le esigenze ormonali materne e la sicurezza del feto. L’idrocortisone (HC) è l’unica molecola raccomandata in gravidanza poiché non attraversa la barriera placentare [1,3].
Il regime di HC in gravidanza deve essere personalizzato e la dose va modulata monitorando segni e sintomi di under- o overtreatment [1].
Pur non esistendo un protocollo definito sulle variazioni posologiche di HC a trimestre, se ne stima un aumento del 20-40% almeno nel terzo [3]. Travaglio, parto ed eventuale taglio cesareo (TC) sono considerati stress che richiedono un aumento della dose di HC [1,3] (Tab 1).
Ipotiroidismo secondario
Gli ormoni tiroidei sono indispensabili per il fisiologico sviluppo neuro-cognitivo del feto e il benessere della madre. In gravidanza il fabbisogno ormonale tiroideo è incrementato e nella donna ipotiroidea questo si traduce nella necessità di un incremento posologico della terapia sostitutiva. Contrariamente a quanto osservato nel deficit primario, in quello secondario non si assiste ad un aumento standard della posologia di L-tiroxina in quanto la paziente ipopituitarica può rispondere, almeno in parte, alla stimolazione della gonadotropina corionica placentare [1], strutturalmente simile al TSH e pertanto in grado di stimolare la produzione di T3 e T4 da parte di una tiroide sana (Fig 1).
Resta comunque importante monitorare la FT4 ogni 4-6 settimane e mantenerne i livelli nel quartile superiore della norma (Tab 1).
Deficit di GH (GHD)
La terapia sostitutiva con GH nella donna con GHD in cerca di fertilità è una pratica clinica standard, mentre il suo proseguimento in corso di gravidanza è ancora controverso.
In condizioni fisiologiche la produzione di GH materno viene progressivamente soppressa per l’aumento, a partire dalla 20a settimana, del GH placentare (Fig 1). Il feto non dovrebbe pertanto risentire degli effetti del GHD, almeno nella seconda metà della gravidanza [2,3] e, in quest’ottica, la terapia con GH potrebbe essere proseguita, almeno nel primo trimestre, per poi essere sospesa a partire dal secondo. [1]. Sono comunque segnalati casi in cui la terapia è stata proseguita oltre il primo trimestre, utilizzando regimi che simulano la fisiologia del GH ipofisario in gravidanza: riduzione della dose nel secondo trimestre e sospensione all’inizio del terzo. Con queste modalità è stato riportato che la terapia con GH è sicura, priva di eventi avversi di rilievo e complicanze ostetriche [2]. Tuttavia, gli studi a disposizione non permettono di avere dati conclusivi sulla sicurezza e l’efficacia nella gestante e nel feto [1,3]. Ad oggi, pertanto, la terapia con GH non è approvata in gravidanza [1,2] (Tab 1).
Ipogonadismo ipogonadotropo
Nella gravida ipopituitarica non è indicata terapia sostitutiva estro-progestinica [1] poiché la produzione è garantita da corpo luteo e placenta (Fig 1).
Diabete insipido (DI)
L’omeostasi idrica si modifica in gravidanza: si riducono la sodiemia, l’osmolalità plasmatica e la soglia osmolare per la secrezione di vasopressina (AVP), aumentano l’acqua corporea totale, la volemia, la clearance di AVP ad opera delle vasopressinasi placentari. Queste condizioni possono slatentizzare forme parziali di DI o aumentare il fabbisogno di desmopressina (DDAVP) [1,3], sebbene la DDAVP, diversamente dall’AVP, non sia metabolizzata dalle vasopressinasi placentari.
La DDAVP è sicura in gravidanza; si segnala un minimo rischio di aumentata contrattilità uterina dovuta alla struttura ossitocina (OXT)-simile del DDAVP, effetto correlato maggiormente alla somministrazione ev [2].
In corso di gravidanza la necessità di eventuali aggiustamenti posologici va valuta clinicamente e biochimicamente [1] (Tab 1).
Prolattina e OXT
La letteratura è scarna sul ruolo di prolattina (PRL) e OXT nella gravida ipopituitarica. La produzione di lattogeno placentare, a partire già dallo stadio di sinciziotrofoblasto, sopperisce all’eventuale mancato incremento della PRL.
In una serie di casi di donne ipopituitariche, la mancata somministrazione di OXT non ha modificato l’avvio del travaglio e la prima fase del parto [4].
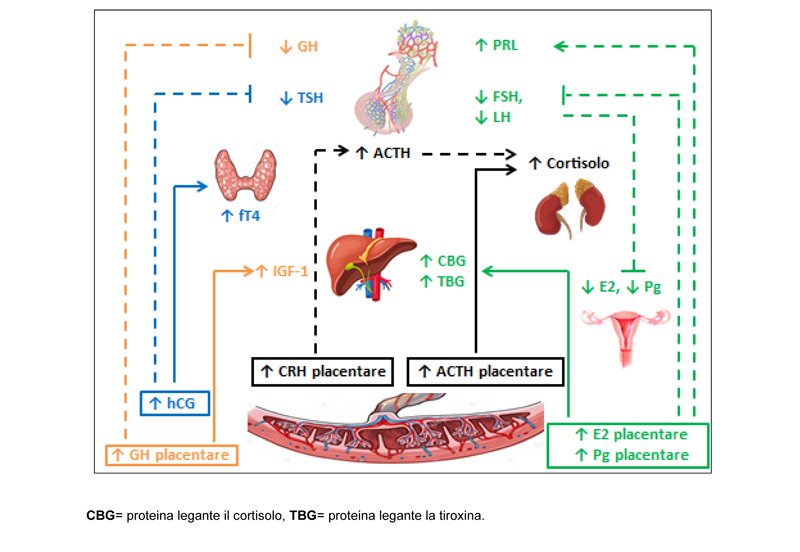 Legenda della Figura
Figura 1. Variazioni ormonali degli assi ipotalamo-ipofisari in gravidanza. Gli ormoni placentari (nei
Legenda della Figura
Figura 1. Variazioni ormonali degli assi ipotalamo-ipofisari in gravidanza. Gli ormoni placentari (nei
rettangoli) sono in grado di influenzare positivamente (freccia) o negativamente (tratto) la produzione
ormonale e la sintesi epatica in una gravida sana. L’hCG (azzurro) agisce sull’asse tiroideo, il CRH e l’ACTH placentare (nero) sulla funzionalità corticosteroidea, il GH placentare (arancione) sull’attività somatotropa, gli steroidi sessuali placentari (verde) sull’asse gonadotropo, sulla produzione di prolattina e la sintesi di proteine di trasporto ormonale.
Alcune di queste fisiologiche variazioni vengono meno nella gravida ipopituitarica (linee tratteggiate).
 Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana
Studi sugli animali Gli autori non hanno eseguito studi sugli animali
Riferimenti Bibliografici



