Sindrome di Cushing iatrogena ed iposurrenalismo terziario.
Ylenia Alessi, Salvo Cannavò, Francesco Ferraù
Dipartimento di Patologia umana DETEV, Università di Messina, Messina, Italia
Autore Corrispondente: F.Ferraù francesco.ferraù@unime.it
Introduzione
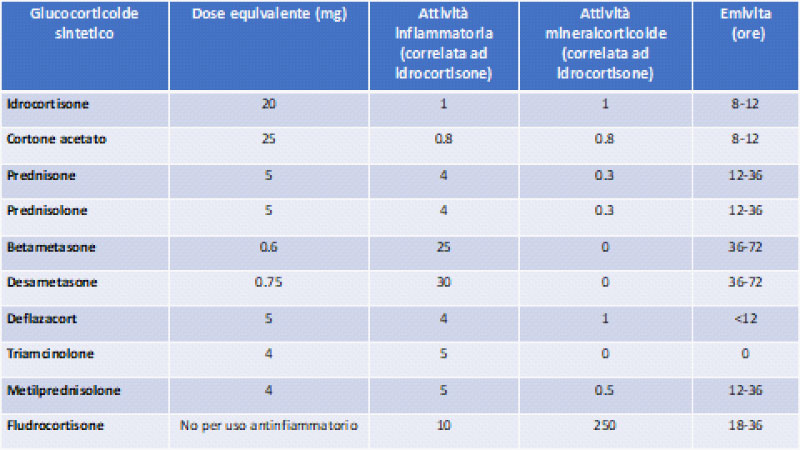
I glucocorticoidi sintetici (GC) (Tabella 1) sono ampiamente utilizzati, a varia posologia e con differente via di somministrazione (orale, inalatoria, topica, intra-articolare e parenterale), per il trattamento di numerose patologie infiammatorie (di pertinenza pneumologica, dermatologica, reumatologica, gastroenterologica etc). La prevalenza dell’uso a lungo termine dei GC si stima essere tra l’1 ed il 3% nella popolazione mondiale. Il manifestarsi degli eventi avversi GC-indotti (Figura 1) dipende da numerosi fattori, inclusi: a) rate di clearance età o malattia dipendente -più rapido nei bambini rispetto agli adulti, nell’ipertiroidismo, ed in pazienti con patologie renali ed epatiche-; b) suscettibilità genetica individuale; c) dose e durata di somministrazione dei GC; d) potenza dei GC (intesa come diversa attività antinfiammatoria/mineralcorticoide a parità di dose); e) via di somministrazione dei GC; f) uso concomitante di farmaci che possono influenzare l'emivita dei GC (1). Tra i possibili eventi avversi associati all’impiego di GC rientrano la sindrome di Cushing iatrogena (CI) e l’insufficienza surrenalica terziaria (AI), condizioni talora interdipendenti.
Cushing iatrogeno (CI)
Tutti gli steroidi con attività glucocorticoide sono in grado di causare la sindrome di CI, in quanto i GC sintetici hanno un'affinità maggiore per il recettore dei glucocorticoidi rispetto al cortisolo stesso (C) (2). ll recettore dei GC (GR) “lower affinity-higher capacity”, di tipo II, ha un'elevata affinità per il desametasone, e un'affinità da 3 a 5 volte e da 10 a 20 volte inferiore a quest’ultimo per il corticosterone e per l'aldosterone, rispettivamente (3).
Qualunque sia il GC specifico, lo sviluppo di segni e sintomi caratteristici dell’ipercortisolismo generalmente è correlato alla dose ed alla durata del trattamento, così che anche GC con breve emivita e potenza inferiore, possono causare effetti “cushingoidi” se somministrati frequentemente ed in quantità eccessive (2).
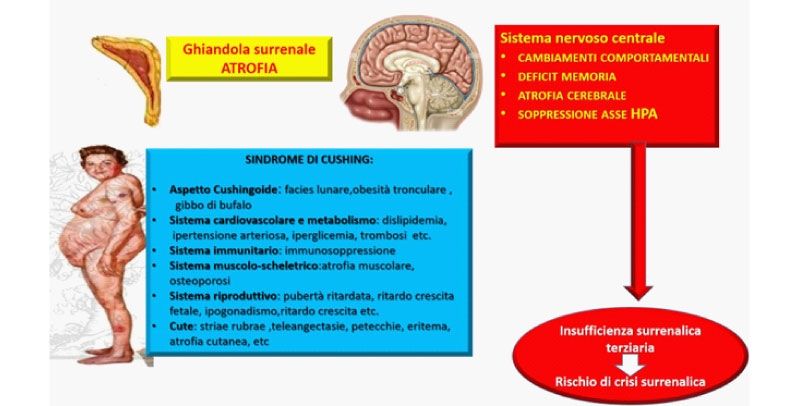
Dal punto di vista clinico i pazienti possono presentare, analogamente ai pazienti con sindrome di Cushing endogeno (CE): ipertensione arteriosa, dislipidemia, alterazioni del metabolismo glucidico, osteoporosi, ipogonadismo, depressione del sistema immunitario, etc. (Figura 1). Dal punto di vista cardiovascolare, si ha un aumento del rischio di insufficienza cardiaca, fibrillazione atriale e flutter (1). Sebbene l'incidenza d’ipertensione arteriosa nei pazienti in trattamento steroideo cronico sia aumentata, tra questi la prevalenza di cardiopatia ipertensiva ed ipokaliemia è comunque minore rispetto ai pazienti con CE, ed è strettamente dipendente dall'attività mineralcorticoide dello steroide che stanno assumendo (2). Allo stesso modo, è raro che i pazienti con CI presentino irsutismo in quanto, a differenza di CE, non si ha un significativo aumento della quota androgenica. I pazienti in trattamento steroideo cronico, inoltre, a differenza di quelli con CE, presentano una maggiore incidenza di glaucoma, cataratta sottocapsulare posteriore, necrosi avascolare della testa del femore, e, sebbene rara, di lipomatosi epidurale spinale (2). Un’interessante revisione della letteratura sull’iperglicemia indotta dai GC mostra come l’aumento dei valori glicemici causato da GC è comune sia tra i pazienti con un’alterata omeostasi glucidica che in quelli non diabetici, evidenziando come l’iperglicemia sia fortemente correlata alla dose cumulativa ed alla durata della terapia con GC (1). L’osteoporosi indotta da GC è la più frequente delle osteoporosi iatrogene, con principale coinvolgimento dell’osso trabecolare (vertebre e costole) e, con rapida diminuzione del rischio di frattura alla cessazione della terapia con GC (1-2). Gli effetti diretti dei GC sulle cellule ossee includono l'induzione dell'apoptosi degli osteoblasti e degli osteociti, l’attivazione della via di segnale wnt e l’induzione di RANKL con conseguente stimolo dell’osteoclastogenesi; tra gli effetti indiretti invece, possiamo annoverare l'ipogonadismo e la riduzione dei livelli dell'ormone della crescita che contribuiscono alla perdita di massa ossea (1-2).
Insufficienza surrenalica terziaria(AI)
Fisiologicamente il cortisolo, come anche gli altri ormoni steroidei, causa una inibizione dell’asse ipotalamo-ipofisi-surrene (HPA) attraverso l’interazione con specifici recettori citoplasmatici che portano a modificazioni geniche trascrizionali e traduzionali (3).
La somministrazione di GC esogeni, anche a piccole dosi e/o per un breve periodo (giorni), causa la soppressione dell'asse HPA sopprimendo la sintesi di POMC, ACTH e altri peptidi derivati da POMC e diminuendo la sintesi e la secrezione di CRH, che risulta essere essenziale per gli eventi posttrascrizionali necessari per il rilascio di ACTH e per il supporto trofico delle ghiandole surrenali (3). Di conseguenza le cellule corticotrope dell'ipofisi anteriore andranno incontro ad atrofia con riduzione della produzione di cortisolo da parte del surrene (1), che conserverà comunque la capacità di secernere mineralcorticoidi, poiché quest'ultima funzione dipende principalmente dal sistema renina-angiotensina.
Le dosi e la durata del trattamento con GC richieste per una significativa soppressione dell'asse HPA variano da individuo a individuo (2). Jamilloux et al. hanno riscontrato che sia la dose cumulativa che la durata del trattamento sono associate a un aumentato rischio di AI, mentre Schlaghecke et al. non hanno trovato alcuna relazione tra la dose o la durata della terapia e l'AI (4). Studi osservazionali stimano la prevalenza di rischio di AI GC-indotta tra il 14% e il 63%, suggerendo che il 6% dei pazienti che si presentano in ospedale con AI potrebbe essere iatrogena (4).
Una importante metanalisi di 36 studi clinici controllati e 38 studi osservazionali, comprendente 3753 individui in terapia con GC, ha riportato un rischio assoluto di insufficienza surrenalica del 31.7% (48.7% nel caso di pazienti trattati con GC orali) (5). La percentuale di pazienti con AI varia molto a seconda della forma di somministrazione, dose e durata di trattamento. In base alla forma di somministrazione, la percentuale di pazienti con AI varia dal 4,2% per i corticosteroidi nasali al 52,2% per i corticosteroidi intra-articolari, con percentuali più elevate nel caso di uso di GC orali (5). A seconda della posologia, la percentuale di insufficienza surrenalica varia dal 2,4% (bassa dose) al 21,5% (alta dose), mentre in base alla durata del trattamento dall'1,4% (28 gg) al 27,4% (1 anno) (5). Questo dimostra che non esiste una forma di somministrazione, dosaggio o una durata del trattamento per cui il rischio di insufficienza surrenalica possa essere escluso con certezza. Secondo i dati di letteratura, nei pazienti che hanno ricevuto una dose di GC pari a più di 20 mg di prednisone/die per più di tre settimane o una dose serale prima di coricarsi ≥5 mg di prednisone per più di alcune settimane (le dosi serali di GC tendono a sopprimere il normale picco mattutino di secrezione di ACTH) la soppressione dell’asse HPA è più "probabile" (3). Considerando che tutti i pazienti in terapia con corticosteroidi sono a rischio di insufficienza surrenalica, è raccomandabile che tutti i soggetti con sintomi aspecifici (quali affaticamento, dolori addominali, nausea), inclusi soprattutto quelli con aspetto Cushingoide, dopo la sospensione degli steroidi, vengano testati per la possibile insufficienza surrenalica tramite un test di stimolo con ACTH (5). Secondo la letteratura, inoltre, vi è una chiara evidenza che l’assunzione di GC a giorni alterni dall’inizio della terapia riduca di molto il rischio di AI (3).
Per quanto riguarda il recupero della funzione dell’asse HPA è stata riscontrata un'enorme variazione individuale; secondo Livanou et al esisterebbe una correlazione tra la dose dei GC somministrati ed il tempo di recupero dell'asse HPA ma nessuna interdipendenza tra quest’ultimo e la durata del trattamento. (2). Dosi maggiori di 7,5 mg/die di prednisone (o equivalente) avevano maggiori probabilità di provocare una soppressione più prolungata dell’asse HPA rispetto a dosi inferiori (2). La percentuale di pazienti con insufficienza surrenalica dopo sospensione di corticosteroidi diminuisce nel tempo anche se, in un numero non irrilevante di pazienti, l’IA persiste per oltre 6 mesi, ed in alcuni casi può raggiungere una durata di oltre 3 anni (4-5). Purtroppo, ad oggi, non ci sono prove sufficienti per dimostrare che gli schemi di riduzione/sospensione della terapia steroidea, mirati a ridurre l’incidenza di AI, siano efficienti o sicuri (5). Tuttavia, è comunque consigliabile una riduzione graduale della terapia steroidea prima della sospensione della stessa, e la verifica della funzionalità dell’asse HPA, tramite test di stimolo con ACTH, dopo l’interruzione del trattamento con GC.
In letteratura è stato inoltre documentato un fenomeno chiamato “sindrome da astinenza da steroidi” (con durata limitata <1 anno), in cui alcuni pazienti mostrano sintomi aspecifici, quali astenia, nausea e artralgie, dopo sospensione di GC nonostante la funzione dell’asse HPA, valutata tramite test di stimolo, sia assolutamente nella norma (2).
Fig.1. Principali effetti dei glucocorticoidi sintetici.
Tab.1. Principali glucocorticoidi sintetici e le loro caratteristiche
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana.
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Nicolaides NC, Pavlaki AN, Maria Alexandra MA, Chrousos GP. Glucocorticoid Therapy and Adrenal Suppression. 2018 Oct 19. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000–. PMID: 25905379.
- Hopkins RL, Leinung MC. Exogenous Cushing's syndrome and glucocorticoid withdrawal.
Endocrinol Metab Clin North Am. 2005 Jun;34(2):371-84
- Paragliola RM, Papi G, Pontecorvi A, Corsello SM. Treatment with Synthetic Glucocorticoids and the Hypothalamus-Pituitary-Adrenal Axis. Int J Mol Sci. 2017 Oct 20;18(10):2201.
- Joseph RM, Hunter AL, Ray DW, Dixon WG. Systemic glucocorticoid therapy and adrenal
insufficiency in adults: A systematic review. Semin Arthritis Rheum. 2016 Aug;46(1):133-41.
- Broersen LH, Pereira AM, Jørgensen JO, Dekkers OM. Adrenal Insufficiency in Corticosteroids Use:
Scarica Articolo PDF